lunes, 20 de junio de 2016
28º
En el día hoy de practica seguimos viendo la película de Marte y al final la terminamos de ver la .En episodio final de la película ,no había casi ningún , La nave que uso el
protagonista para salir de Marte no llevaba suficiente combustión y no
pudo llegar cerca de la Hermes , entonces el protagonista ideo un plan donde tenía que
pincharse el traje por la mano y impulsándose hacía la nave , al final la
comandante acepto y tuvieron que calcular con los problemas de encuentro
que velocidad relativa tenía la comandante , la cual tenía que agarrar al comandante y que al final lo pudo salvar. Unos años después los protagonistas lo estuvieron comentando y como EEUU y China se aliaron para salvar al astronauta y de como se alegraron al saber que su compañero esta vivo . Esta película nos a ayuda mucho en cuanto a términos científicos .
martes, 31 de mayo de 2016
26º
Hoy hemos seguido viendo la película de Marte y anotando las reacciones químicas
-Físicos: Químicos
La nave sufre una fuerza de 7G lateral, - Muerte de las plantas, muerte de las
bacterias por la atmósfera de Marte,
La toma de nicotina del protagonista,
la transmisión entre el protagonista y la tierra, la brecha del HUB - Uno de la NASA explica los tipos de combustión de las naves,
que hace que explote el túnel.
la aceleración de la nave Hermess al acercarse de la tierra,
en vez de desacelerar.
Y nos dijo de buscar otra vez estas preguntas:
¿A que se debe la fisura del HUB?
Se debió a una brecha en el HUB
¿Que hace la vicodina en el cuerpo humano?
Los efectos de la vicotina en el hombre dependen de la dosis, pudiendo comportarse como un estimulante o como un bloqueante de la transmisión nerviosa ganglionar. Como estimulante produce un aumento de la atención, mejora la memoria y disminuye la irritabilidad.
-Físicos: Químicos
La nave sufre una fuerza de 7G lateral, - Muerte de las plantas, muerte de las
bacterias por la atmósfera de Marte,
La toma de nicotina del protagonista,
la transmisión entre el protagonista y la tierra, la brecha del HUB - Uno de la NASA explica los tipos de combustión de las naves,
que hace que explote el túnel.
la aceleración de la nave Hermess al acercarse de la tierra,
en vez de desacelerar.
Y nos dijo de buscar otra vez estas preguntas:
¿A que se debe la fisura del HUB?
Se debió a una brecha en el HUB
¿Que hace la vicodina en el cuerpo humano?
Los efectos de la vicotina en el hombre dependen de la dosis, pudiendo comportarse como un estimulante o como un bloqueante de la transmisión nerviosa ganglionar. Como estimulante produce un aumento de la atención, mejora la memoria y disminuye la irritabilidad.
20º
Hoy la maestra y nosotros hicimos un análisis de la práctica anterior , llegamos a la conclusión de que no hicimos bien la práctica por unas situaciones que hicimos mal :No enrasamos bien, es decir las disoluciones no tienen la concentración que calculamos.No probamos el grifo de la bureta y había que hacerlo antes de la valoración.Echamos NaOH en vez de KOH. Y llegamos a la conclusión de que,Un volumen de ácido neutraliza con otro volumen de base. Se reconoce la valoración cuando la disolución de HCl vira a rosa por efecto del indicador, fenolftaleina.
25º
Este lunes, continuamos viendo la película Marte y añadimos otras reacciones que salían en la pelicula
Químicos Físicos
-Producción de energía solar La Pathfinder
- La radio actividad de un isótopo.
La maestra dijo que buscáramos información sobre la Pathfinder.Y esto es lo que he encontrado sobre la Pathfinder:
Químicos Físicos
-Producción de energía solar La Pathfinder
- La radio actividad de un isótopo.
La maestra dijo que buscáramos información sobre la Pathfinder.Y esto es lo que he encontrado sobre la Pathfinder:
Mars Pathfinder fue la primera de una serie de misiones a Marte que incluyen rovers(vehículos robóticos de exploración). Esta misión a Marte fue la más importante desde que las vikingaterrizaran sobre el planeta rojo en 1976 .
La Mars Pathfinder fue lanzada el 4 de Diciembre de 1996 a bordo de un cohete Delta, un mes después del lanzamiento del Mars Global Survevor y luego de 7 meses de viaje llegó a Marte el 4 de Julio de 1997. El sitio de aterrizaje es Ares Vallis (Valle de Marte) en unregión llamada Chryse Planita (Planicies de Oro). Durante el viaje la nave realizó cuatro correcciones de vuelo:
Al rover llamado Sojourner (en honor a la famosa abolicionista estadounidense Soujourner Truth) que realizaría diferentes experimentos en la superficie marciana.
24º
Hoy la maestra, nos a puesto una política y nos a dicho que apuntaramos los efectos físicos y químicos.
Físicos Químico
-Si se abre una brecha en el HUB todo explotaría.
- La fuerza de la tormenta. -Despegue de la nave.
-La excesiva inclinación de la nave. -El uso de inflarojos.
-Ley de acción y reacción de Newton. -Señales vitales del prota.
-Depuración del traje. -Como generar ->H+O(con idrazina y un catalizador
-La condesación del agua en el plástico. de igridio).
-Cuando al generar H2O no
no tuvo en cuenta el O2 excedente.
-Su proceso de curación.
-Cuando cataliza la luz para hacer energía.
-La cultivación de patata.
La maestra tambien nos dijo que teníamos que contestar las siguientes preguntas:
¿Que diferencia hay entre la densidad de la atmósfera de Marte con la de la Tierra?
Marte es el cuarto planeta del sistema solar, y su atmósfera es muy diferente de la atmósfera de la Tierra. Recientemente ha habido mayor interés en el estudio de su composición por la detección de pequeñas cantidades de metano , que podrían indicar la existencia de alguna forma de vida de Marte . La atmósfera de Marte está compuesta principalmente por dióxido de carbono (95%), nitrogeno (3%) y argón(1,6%), y contiene trazas de oxígeno,agua y metano
¿Podría Marte generar una tormenta de arena como la de la película?
Uno de ellos es, sin lugar a dudas, el de las potentes tormentas de arena que se desatan en su superficie. Muchos podrán preguntarse qué tiene de extraordinario una tormenta de arena cuando aquí en la Tierra las hay de a millones. El problema está en que Marte cuenta con una baja densidad y una escasa gravedad que lleva a que haga falta un viento 10 veces más intenso que en la Tierra para que se origine una tormenta.
23º
Hoy hemos hecho las reacciones ajustadas y su fundamento científico.Faltaban dos grupos por hacer:
- Reacción de cambio de color: K2Cr2O7 + NaOH
- Reacción ajustada: K2Cr2O7 + 2NaOH -------) 2Na2CrO4 + 2KOH + H2O
Es una reacción de doble desplazamiento con cambio de color de un color amarillento hacia uno anaranjado.
Usos:-Cromar metales,fabricar jabones o pinturas.
- Reacción de formación de complejos: FeCl3 +KSCN
- Reacción ajustada: FeCl3 + 6KSCN ---------)K3[Fe (SCN) 6] + 3KCL
La sustancia producida se llama complejo o de combinación. Es una sustancia formada por un átomo o catión central rodeado por moléculas o aniones, geométricamente ubicadas.Uso para la sangre
- Reacción de cambio de color: K2Cr2O7 + NaOH
- Reacción ajustada: K2Cr2O7 + 2NaOH -------) 2Na2CrO4 + 2KOH + H2O
Es una reacción de doble desplazamiento con cambio de color de un color amarillento hacia uno anaranjado.
Usos:-Cromar metales,fabricar jabones o pinturas.
- Reacción de formación de complejos: FeCl3 +KSCN
- Reacción ajustada: FeCl3 + 6KSCN ---------)K3[Fe (SCN) 6] + 3KCL
La sustancia producida se llama complejo o de combinación. Es una sustancia formada por un átomo o catión central rodeado por moléculas o aniones, geométricamente ubicadas.Uso para la sangre
domingo, 15 de mayo de 2016
12º
En este día, no pudimos hacer el proyecto porque nuestra compañera falto y no se trajo el material que tenía que traer,pero mis compañeros si estuvieron haciendo la práctica de como averiguar la temperatura de un sólido pero se quedaron sin tiempo de clase ya que tardaron un poco en montar las herramientas para calentar el azufre.
Ellos calentaron el azufre al baño maría, cuando el agua llego a una temperatura de 90º íban anotando cada medio segundo cuanto temperatura subía pero cuando llego a la temperatura de 110º no subía más la temperatura y necesitábamos una temperatura de 120º para que se fundiera así que decidimos echar sal para que aumentara la temperatura y lo consiguieron .

Ellos calentaron el azufre al baño maría, cuando el agua llego a una temperatura de 90º íban anotando cada medio segundo cuanto temperatura subía pero cuando llego a la temperatura de 110º no subía más la temperatura y necesitábamos una temperatura de 120º para que se fundiera así que decidimos echar sal para que aumentara la temperatura y lo consiguieron .
11º
En este día, íbamos a hacer las pruebas de como se determina el punto de fusión de un solido pero las bolitas de naftalina que trajeron no eran muy concentradas y su punto de fusión no era el adecuado y también la maestra nos dijo que el próximo día traigamos azufre para ver si podríamos usarlo .
7º
Este día de clase la profesora nos estuvo comentando como un medico calcula la cantidad de un medicamento que se tienen que tomar una persona(según su edad y peso) además también nos comento lo perjudicial que es si se toman de mas los niños o los adultos de un medicamento(afecta a tu hígado por que a tu cuerpo le costaría mas eliminar esta sustancia).Y también nos comento sobre el próximo proyecto lo que había que traer:
1º ,jabón
2º,aguas diferente , por ejemplo, de un charco, de un río, agua mineral ...ect
3º, y botellas del mismo tamaño que las de nuestros compañeros
1º ,jabón
2º,aguas diferente , por ejemplo, de un charco, de un río, agua mineral ...ect
3º, y botellas del mismo tamaño que las de nuestros compañeros
9º
En este día tengo que hablaros del proyecto de la 8º practica que tuvimos que repetirlo,con más precisión , por ejemplo usando probetas y filtrando el agua y al final nos salio bien
8º
 En este día, os voi a hablar del proyecto pendiente sobre el agua,en primer lugar os voi a hacer un pequeño resumen de lo que hicimos, pues la maestra lo explico y estuvimos cogiendo botella por botella y poniendo agua de cada tipo y jabón para saber cuanta espuma tiene el agua. Aquí os dejo lo pasos:
En este día, os voi a hablar del proyecto pendiente sobre el agua,en primer lugar os voi a hacer un pequeño resumen de lo que hicimos, pues la maestra lo explico y estuvimos cogiendo botella por botella y poniendo agua de cada tipo y jabón para saber cuanta espuma tiene el agua. Aquí os dejo lo pasos:1ºPaso: planificar entre todo el grupo los instrumentos e ingredientes que llevareis cada uno(necesitáis varios tipos de aguas diferentes, una regla para medir la espuma que se genere pero con un hilo se mide mas rápido, jabón y agua destilada
2ºmarcar cada botella con un numérico y en una hoja apuntar todas las cantidades y resultados que os de.
3º Paso: coger varias botellas y llenar cada una con agua de distinto tipo y lugar.
5º Paso: agitar la botella para que se genere la espuma(porque el jabón rompe la tensión superficial del agua)
6ºPaso: medir la espuma generada y anotar las medidas
7 ºPaso: poner en común vuestras anotaciones con vuestra clase.
15º
Este lunes, no pudimos empezar el proyecto con la maestra porque estuvimos buscando los productos químicos para poder hacer el proyecto y también nos dijo que buscáramos información sobre las reacciones el ácido base (en una reacción química que ocurre entre un ácido y una base produciendo una sal y agua), pero tampoco nos podíamos meter ya que hay un problema en nuestro instituto que no nos deja meternos en el blogger.
domingo, 24 de abril de 2016
22ª
Buenas junta a mi maravillosa maestra Mila cada uno presentemos la reacción quimica de cada uno y nos estuvo un poco en lo que no equivocamos. Y esta son:
-Reacción ajustada ( 2NaCl + H2O +CO2
Reacción de desprendimiento de gases: se desprende CO2
Usos: Se usa para hacer bicarbonatos, carbonatos y bebidas carbonatadas.Precipitado amarillo
-Reacción de precipitación: FeCl3+ 3NaOH) Fe(OH)3 + 3NaCl
Usos: se usa para la industria textil, de jabón y papel. Precipitado rojizo
- Reacción de precipitación: Pb(NO3)2 + 2KI-) PbI2 + 2KNO3
-
Usos: Cromar metales y fabricar jabones y pintura . Precipitado amarillo
-Reacción ajustada ( 2NaCl + H2O +CO2
Reacción de desprendimiento de gases: se desprende CO2
Usos: Se usa para hacer bicarbonatos, carbonatos y bebidas carbonatadas.Precipitado amarillo
-Reacción de precipitación: FeCl3+ 3NaOH) Fe(OH)3 + 3NaCl
Usos: se usa para la industria textil, de jabón y papel. Precipitado rojizo
- Reacción de precipitación: Pb(NO3)2 + 2KI-) PbI2 + 2KNO3
-
Usos: Cromar metales y fabricar jabones y pintura . Precipitado amarillo
domingo, 17 de abril de 2016
21ª
Buenas, os voy a explicar a que se debe dicha disolución y es porque los iones de disolución , al juntarse cambian de color.
La reacción química del hierro férrico y el Na OH:
FeCl3 + 3NaOH-------- Fe(OH)3 pp + 3NaCl ac
la reacción es de doble sustitución en la cual los iones hidróxilo en solución reaccionan con el ión fèrrico, para formar un precipitado pardo rojizo, los iones cloruro y Na+ practicamente permanecen en solución desde el inicio, es decir:
Fe3+ + 3 Cl- + 3 Na + 3 OH- --------- Fe(OH)3 pp + 3 Cl-
+ 3 Na+
o sea practicamente solo reacciona el ferrico con los hidroxilos
si filtras el hidroxido precipitado y evaporas el solvente obtendras cloruro de sodio.
la reacción es de doble sustitución en la cual los iones hidróxilo en solución reaccionan con el ión fèrrico, para formar un precipitado pardo rojizo, los iones cloruro y Na+ practicamente permanecen en solución desde el inicio, es decir:
Fe3+ + 3 Cl- + 3 Na + 3 OH- --------- Fe(OH)3 pp + 3 Cl-
+ 3 Na+
o sea practicamente solo reacciona el ferrico con los hidroxilos
si filtras el hidroxido precipitado y evaporas el solvente obtendras cloruro de sodio.
La aplicación del hierro férrico.El uso más extenso del hierro (fierro) es para la obtención de aceros estructurales; también se producen grandes cantidades de hierro fundido y de hierro forjado. Entre otros usos del hierro y de sus compuestos se tienen la fabricación de imanes, tintes (tintas, papel para heliográficas, pigmentos pulidores) y abrasivos (colcótar).
La aplicación del NaOH son, la industria del papel, la industria textil, la fabricación de jabón y eso da trabajo a más de 3 millones de personas.
domingo, 3 de abril de 2016
19º
Hoy la maestra nos explico lo que haríamos en el siguiente práctica, los cálculos necesarios para nuestra práctica en la parte de los sólidos.
Masa(g)
----------------
Nº de moles Peso molar
Molaridad= ------------------ = ---------------------
Volumen(L) Volumen (L)
El peso molar :
Sacamos la masa molecular H2= 2 x 1u=2u
Con ese dato sacamos la masa molar(o peso molar) H2= 2g
Y también nos explicó la clasificación M.R.Q según el/los productos que se obtienen de una disolución: el cambio de color y el precipitado
Masa(g)
----------------
Nº de moles Peso molar
Molaridad= ------------------ = ---------------------
Volumen(L) Volumen (L)
El peso molar :
Sacamos la masa molecular H2= 2 x 1u=2u
Con ese dato sacamos la masa molar(o peso molar) H2= 2g
Y también nos explicó la clasificación M.R.Q según el/los productos que se obtienen de una disolución: el cambio de color y el precipitado
17º
Valoración ácido base koh y
La maestra y nosotros hicimos un análisis de la práctica anterior y llegamos a la conclusión de que no hicimos bien la práctica, por culpa de que hicimos una serie de cosas mal,noo enrasamos bien, es decir las disoluciones no tienen la concentración que calculamos,no probamos el grifo de la bureta y había que hacerlo antes de la valoración,después eechamos NaOH en vez de KOH y llegamos a la conclusión de que. y tambien de que la valoración cuando la disolución de HCl vira a rosa por efecto del indicador, fenolftaleina .Nuestro grupo , prepararo la cantidad de hidróxido de potasio necesarios, el ácido clorhídrico y el hidróxido potásico lo pesaremos en una balanza , también nos hará falta fenolftaleina que sera el indicador del ácido y agua destilada para diluir el KOH y el HCL, añadimos unas gotas de fenolftaleina al ácido clorhídrico y en la bureta echamos el hidróxido potásico (estos dos diluidos en agua destilada) abrimos la bureta y hacemos que de muy poco en poco vaya cayendo una gota de KOH sobre el HCL(este contenido en el erlenmeyer) el erlenmeyer tiene que estar todo el rato moviéndose (como veréis en el vídeo que os dejaré) y cuando que veáis que el HCL se esta poniendo rosa o morado y que se mantiene habréis conseguido hacer bien la practica, luego medís cuanto KOH ha sobrado y se lo restáis al que había al principio y así sabréis cuanta basicidad tendrá el HCL.También tengo que comentar que al final de experimento ,al agitar el Erlenmeyer nos salio una sustancia rosa .
domingo, 21 de febrero de 2016
16º
´ Valoración- ácido- base
A continuación mostramos una simulación con la cual podemos realizar una valoración ácido-base. Podemos elegir el método de trabajo: usar un ph-metro o un indicador, encender el agitador magnético, observar la bureta de cerca, enrasarla tal como se haría en el laboratorio, abrir y cerrar la llave de la bureta (el proceso de vaciado de la bureta puede parecer lento, pero tratamos de simular una valoración real y normalmente esta no se debe de hacer a "chorro abierto") . Se puede repetir la misma valoración utilizando otro método o bien iniciar una nueva determinación.
Una valoración ácido-base (también llamada volumetría ácido-base, titulación ácido-base o valoración de neutralización) es una técnica o método de análisis cuantitivo muy usada, que permite conocer la concentracion desconocida de una disolución de una sustancia que pueda actuar como acido neutralizada por medio de una base de concentración conocida, o bien sea una concentración de basedesconocida neutralizada por una solución de ácido conocido . Es un tipo de valoración basada en una reacción ácido -base o reacción neutralizada entre el analito (la sustancia cuya concentración queremos conocer) y la sustancia valorante. El nombre volumetría hace referencia a la medida del volumen de las disoluciones empleadas, que nos permite calcular la concentración buscada.

martes, 16 de febrero de 2016
13º
Esta semana ,no podíamos terminar la temperatura de fusión del azufre porque la temperatura de ebullición del agua era similar a la temperatura de fusión del azufre por lo que seria muy difícil pasar de los 100ºC. Entonces, la maestra decidió hacer las tablas de fusión y enfriamiento con unos datos basados en los que habíamos anotado la semana pasada y nos salieron estos resultados:
:
:

14º
El indicador de pH casero: Lombarda
Esta semana en el laboratorio estuvimos midiendo el pH de una serie de sustancias mediante un indicador de pH casero.Para poder hacer este trabajo se necesita:-Lombarda.-Vaso de precipitados grande.-Mechero Bunsen.-Soporte con aro.Probetas.-Cuentagotas.Sustancias variadas que teníamos en casa.Agua destilada.
Primero cogimos la lombarda y la pusimos a hervir cuando se disolvió ,cogimos su liquido mediante un cuentagotas, pero de cada mezcla había que limpiarlo con agua destilada y lo mezclemos con las otras sustancias mediante los tubos ensayo y al final vimos los colores que nos dieron en cada sustancia.


Esta semana en el laboratorio estuvimos midiendo el pH de una serie de sustancias mediante un indicador de pH casero.Para poder hacer este trabajo se necesita:-Lombarda.-Vaso de precipitados grande.-Mechero Bunsen.-Soporte con aro.Probetas.-Cuentagotas.Sustancias variadas que teníamos en casa.Agua destilada.
Primero cogimos la lombarda y la pusimos a hervir cuando se disolvió ,cogimos su liquido mediante un cuentagotas, pero de cada mezcla había que limpiarlo con agua destilada y lo mezclemos con las otras sustancias mediante los tubos ensayo y al final vimos los colores que nos dieron en cada sustancia.


10º
Capilares
En esta semana la maestra Mila nos a enseñado a hacer capilares, en el que consistía en coger el mechero bunsen y encima de la llama poner el capilar hasta que se pueda estirar y luego, nos va a salir el capilar. Bueno aquí os dejo lo que es un capilar.
Este maravilloso mechero bunsen fue creado por Robert Bunsen en 1857 y provee una transmisión muy rápida de calor intenso en el laboratorio. Es un quemador de gas natural o preparado del tipo de premezcla y la llama es el producto de la combustión de una mezcla de aire y gas butano.
Si los agujeros laterales están cerrados el gas sólo se mezcla con el oxigeno atmosférico en el punto superior de la combustión ardiendo con menor eficacia y produciendo una llama de temperatura más fría y color rojizo o amarillento, la cual se llama "llama segura" o "llama luminosa". Esta llama es luminosa debido a pequeñas partículas de hollín incandescentes. invisibles contra un fondo uniforme.Hay distintos tipos de llama en un quemador Bunsen dependiendo del flujo de aire ambiental entrante en la válvula de admisión (no confundir con la válvula del combustible).
1. Válvula del aire cerrada (llama segura).2. Válvula medio abierta.3. Válvula abierta al 90 %.4. Válvula abierta por completo (llama azul crepitante; se recomienda el uso de ésta ya que no deja residuos de carbón sobre lo que calentamos).
La maestra Mila nos explico como hacer los codos, se calienta el vidrio uniformemente, Pero para hacer esto no usaríamos toda la varilla,habría que cortar la varilla.Para ello hay que hacerle un pequeño surco con una lima y partirlo.Luego calentar un poco la punta y dar unos golpecitos sobre una superficie lisa para dejar el filo suave.


lunes, 18 de enero de 2016
6º
El pasado lunes hicimos un experimento con el mechero bunssen, y teniamos que buscar información sobre las bolas de nactalina.
La naftalina (nombre no comercial: naftalina; fórmula química: C10H8) es un sólido blanco que se volatiliza fácilmente y se produce naturalmente cuando se queman combustibles. También se llama alquitrán blanco y se ha usado en bolas y escamas para ahuyentar las polillas.Quemar tabaco o madera produce naftalina. Tiene un olor tan fuerte que puede resultar desagradable. La 1-metilnaftalina y la 2-metilnaftalina son compuestos similares a la naftalina. La 1-metilnaftalina es un líquido transparente y la 2-metilnaftalina es un sólido; ambos pueden olerse en el aire y en el agua en concentraciones muy baja.
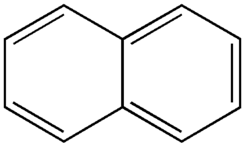

www.wikipedia.com
La naftalina (nombre no comercial: naftalina; fórmula química: C10H8) es un sólido blanco que se volatiliza fácilmente y se produce naturalmente cuando se queman combustibles. También se llama alquitrán blanco y se ha usado en bolas y escamas para ahuyentar las polillas.Quemar tabaco o madera produce naftalina. Tiene un olor tan fuerte que puede resultar desagradable. La 1-metilnaftalina y la 2-metilnaftalina son compuestos similares a la naftalina. La 1-metilnaftalina es un líquido transparente y la 2-metilnaftalina es un sólido; ambos pueden olerse en el aire y en el agua en concentraciones muy baja.


www.wikipedia.com
Suscribirse a:
Entradas (Atom)



